



版權說明:本文檔由用戶提供并上傳,收益歸屬內容提供方,若內容存在侵權,請進行舉報或認領
文檔簡介
1、第二節 水的電離和 溶液的酸堿性一、水的電離一、水的電離.水是一種極弱的電解質,能微弱的電離水是一種極弱的電解質,能微弱的電離:25,純水,純水+ H2O+H2O H3O+OH ( H2O H+OH)C(H+)=C(OH-)=110-7mol/L平衡常數:平衡常數:K 電離電離C(H+)C(OH-) C(H2O)在一定溫度時:在一定溫度時:C(H+)C(OH-)=Kw,叫叫水的離子積水的離子積25時,時,Kw=110-142、水的、水的離子積離子積水的濃度為常數,所以水的濃度為常數,所以 K W C(H+)C(OH-)提問:根據前面所學知識,水的離子積會提問:根據前面所學知識,水的離子積會受什
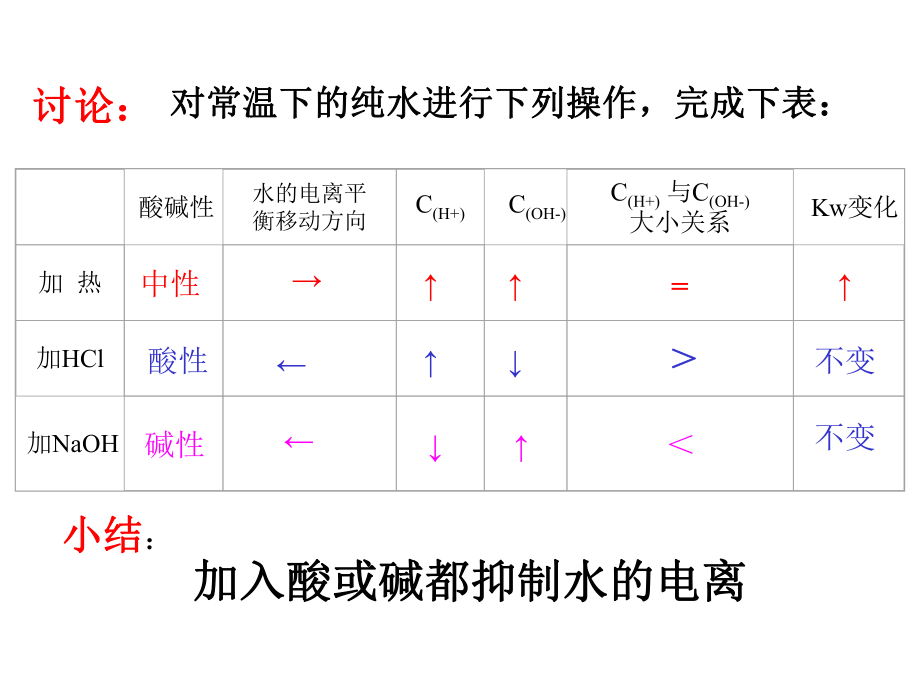
2、么外界條件影響?受什么外界條件影響?分析下表中的數據有何規律,并解釋之分析下表中的數據有何規律,并解釋之 討論:討論:溫溫度度0202550100Kw1.1410-156.8110-15110-145.4710-14110-12結論:結論:溫度越高,溫度越高,Kw越大,水的電離是一個吸熱過程越大,水的電離是一個吸熱過程討論:討論:對常溫下的純水進行下列操作,完成下表:對常溫下的純水進行下列操作,完成下表: 酸堿性水的電離平衡移動方向C(H+)C(OH-)C(H+) 與C(OH-)大小關系Kw變化加 熱 加HCl 加NaOH 中性=酸性不變堿性不變小結小結:加入酸或堿都抑制水的電離加入酸或堿都抑
3、制水的電離3、影響水電離的因素、影響水電離的因素(1)加入酸或堿,抑制水的電離,)加入酸或堿,抑制水的電離, Kw不變;不變;(2)升高溫度,電離過程是一個)升高溫度,電離過程是一個 吸熱過程,促進水的電離,水吸熱過程,促進水的電離,水 的離子積增大,在的離子積增大,在100時,時, KW=11012。新課的延伸:新課的延伸:1、C(H)=1107mol/L,溶液一定呈中性嗎?,溶液一定呈中性嗎?說明:溶液或純水呈中性,是因為溶液中說明:溶液或純水呈中性,是因為溶液中 C(H)=C(OH)2、純水、純水或中性溶液或中性溶液中:中:C(H )=C(OH)=Kw注意注意: 任何水溶液中任何水溶液中
4、H+和和OH總是同時存在的總是同時存在的,只只是相對含量不同是相對含量不同.根據根據Kw=C(H)C(OH) 在特定溫度下為在特定溫度下為 定值定值,C(H) 和和C(OH) 可以互求可以互求.不論是在中性溶液還是在酸堿性溶液,水不論是在中性溶液還是在酸堿性溶液,水電離出的電離出的C(H+)C(OH)常溫下常溫下,任何稀的水溶液中任何稀的水溶液中 C(H+)C(OH)=11014 練習練習 室溫室溫0.1mol/L的鹽酸溶液中水電離出的的鹽酸溶液中水電離出的C(H )和和C(OH)是多少是多少? 室溫室溫0.1mol/L的的NaOH溶液中水電離出的溶液中水電離出的C(H)和和C(OH)是多少是多少?水電離出的水電離出的C(OH-)=110-14/0.1=110-13mol/L = C(H )課堂小結:課堂小結:一、水的電離:一、水的電離:1、水是一種極弱的電解質,能微弱的電離;、水是一種極弱的電解質,能微弱的電離;2、水的、水的離子積常數離子積常數Kw ;3、影響水電離的因素。、影響水
溫馨提示
- 1. 本站所有資源如無特殊說明,都需要本地電腦安裝OFFICE2007和PDF閱讀器。圖紙軟件為CAD,CAXA,PROE,UG,SolidWorks等.壓縮文件請下載最新的WinRAR軟件解壓。
- 2. 本站的文檔不包含任何第三方提供的附件圖紙等,如果需要附件,請聯系上傳者。文件的所有權益歸上傳用戶所有。
- 3. 本站RAR壓縮包中若帶圖紙,網頁內容里面會有圖紙預覽,若沒有圖紙預覽就沒有圖紙。
- 4. 未經權益所有人同意不得將文件中的內容挪作商業或盈利用途。
- 5. 人人文庫網僅提供信息存儲空間,僅對用戶上傳內容的表現方式做保護處理,對用戶上傳分享的文檔內容本身不做任何修改或編輯,并不能對任何下載內容負責。
- 6. 下載文件中如有侵權或不適當內容,請與我們聯系,我們立即糾正。
- 7. 本站不保證下載資源的準確性、安全性和完整性, 同時也不承擔用戶因使用這些下載資源對自己和他人造成任何形式的傷害或損失。
最新文檔
- 工業園區規劃與產業升級策略
- 工業排污控制與治理
- 工業旅游景區規劃與環境設計研究
- 工業機器人設計與維護指南
- 工業廢水處理工程驗收案例分享
- 工業機器人技術及其產業發展
- 工業機器人故障診斷與預防技術
- 工業設備故障排查與預防措施
- 工業涂裝生產線的發展趨勢與挑戰
- 工業設計在智能制造中的作用
- 2025年甘肅省高考化學試卷真題(含答案解析)
- 叉車工安全考試
- 公安院校公安專業招生考生患病經歷申報表
- (2025)發展對象必考試題與答案
- 第一課-入鄉隨俗《發展漢語-初級綜合2》
- 2025年長春市軌道交通集團有限公司校園招聘(693人)筆試參考題庫附帶答案詳解析版
- 建立健全各項管理制度
- 定期體檢健康管理制度
- 病媒生物試題及答案
- T/CHC 1001-2019植物源高有機硒食品原料
- ISO 37001-2025 反賄賂管理體系要求及使用指南(中文版-雷澤佳譯-2025)

評論
0/150
提交評論