



版權說明:本文檔由用戶提供并上傳,收益歸屬內容提供方,若內容存在侵權,請進行舉報或認領
文檔簡介
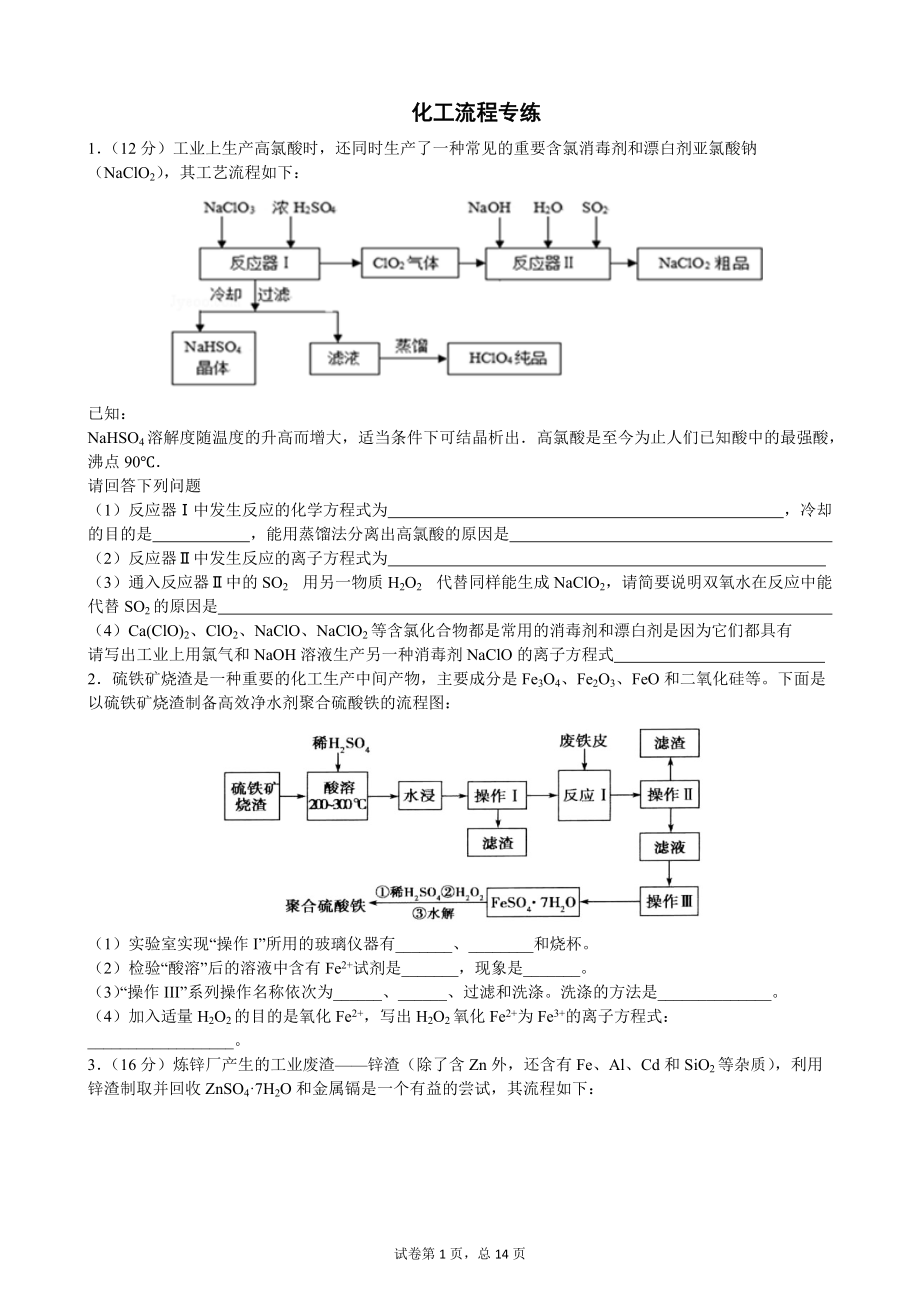
1、 化工流程專練1(12分)工業上生產高氯酸時,還同時生產了一種常見的重要含氯消毒劑和漂白劑亞氯酸鈉(NaClO2),其工藝流程如下:已知:NaHSO4溶解度隨溫度的升高而增大,適當條件下可結晶析出高氯酸是至今為止人們已知酸中的最強酸,沸點90請回答下列問題(1)反應器中發生反應的化學方程式為 ,冷卻的目的是 ,能用蒸餾法分離出高氯酸的原因是 (2)反應器中發生反應的離子方程式為 (3)通入反應器中的SO2 用另一物質H2O2 代替同樣能生成NaClO2,請簡要說明雙氧水在反應中能代替SO2的原因是 (4)Ca(ClO)2、ClO2、NaClO、NaClO2等含氯化合物都是常用的消毒劑和漂白劑是
2、因為它們都具有 請寫出工業上用氯氣和NaOH溶液生產另一種消毒劑NaClO的離子方程式 2硫鐵礦燒渣是一種重要的化工生產中間產物,主要成分是Fe3O4、Fe2O3、FeO和二氧化硅等。下面是以硫鐵礦燒渣制備高效凈水劑聚合硫酸鐵的流程圖:(1)實驗室實現“操作I”所用的玻璃儀器有_、_和燒杯。(2)檢驗“酸溶”后的溶液中含有Fe2+試劑是_,現象是_。(3)“操作III”系列操作名稱依次為_、_、過濾和洗滌。洗滌的方法是_。(4)加入適量H2O2的目的是氧化Fe2+,寫出H2O2氧化Fe2+為Fe3+的離子方程式:_。3(16分)煉鋅廠產生的工業廢渣鋅渣(除了含Zn外,還含有Fe、Al、Cd和S
3、iO2等雜質),利用鋅渣制取并回收ZnSO4·7H2O和金屬鎘是一個有益的嘗試,其流程如下:已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氫氧化物完全沉淀時的pH分別為:3.2,4.7,6.5,9.4,9.7;鋅的金屬活動性比鎘強。試回答下列問題:(1)“浸出”時用到的“試劑X”為 (填名稱)。(2)寫出“氧化”過程的離子方程式 。(3)“調pH”過程可以選用 。(從以下選項選擇,填序號)AH2SO4 BZnO CNaOH“濾渣2”的主要成分是 (填化學式,下同)。(4)“試劑Y”是_(5)“操作1”是 ;在“操作1”時,必須采取的實驗措施是 。4(16分)某地煤矸石經預處
4、理后主要含SiO2(61%)、Al2O3(30%)和少量的Fe2O3、FeO及鈣鎂的化合物等。某實驗小組利用其提取Al(OH)3。(1)“酸浸”過程中發生的主要反應的離子方程式為 。為提高“酸浸”時鋁浸出率,可采取的措施之一是 。(2)“氧化”的目的是 。檢驗Fe3+已水解完全的方法是 。(3)濾渣的主要成分是CaCO3、Mg(OH)2和 。(4)上述流程中可循環利用的物質的化學式是 。“轉化”時主要反應的離子方程式為 。(5)Fe3+開始沉淀和沉淀完全的pH分別為2.1和3.2,Al3+開始沉淀和沉淀完全的pH分別為4.1和5.4。為了獲得產品Al(OH)3,從氧化后的溶液開始,若只用純堿一
5、種試劑,后續操作是 。5(16分)鋅浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,工業上可通過控制條件逐一除去雜質以制備超細活性氧化鋅,其工藝流程如下:(1)鋅浮渣利用硫酸浸出后,將濾渣1進行再次浸出,其目的是 。(2)凈化1是為了將Mn2+轉化為MnO2而除去,試寫出該反應的離子方程式 。(3)90時,凈化2溶液中殘留鐵的濃度受pH影響如圖。pH值中等時,雖有利于Fe2+轉化為Fe3+,但殘留鐵的濃度仍高于pH為34時的原因是 。(4)濾渣3的主要成份為 (填化學式)。(5)碳化在50進行,“前驅體”的化學式為ZnCO32Zn(OH)2H2O,寫出碳化過程生成“前驅體”的化
6、學方程式 ;碳化時所用NH4HCO3的實際用量為理論用量的1.1倍,其原因一是為了使Zn2+充分沉淀,二是 。6粉煤灰是燃煤電廠的廢渣,主要成分為SiO2、Al2O3、Fe2O3和C等。實驗室模擬工業從粉煤灰提取活性Al2O3,其流程如圖:已知燒結過程的產物主要是:NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等。(1)寫出燒結過程中鋁元素轉化的化學方程式 。(2)操作a為冷卻、研磨,其中研磨的目的是 。(3)浸出過程中,NaFeO2可完全水解,水解反應的離子方程式為 。(4)操作b的名稱是 ,所用的玻璃儀器有 、 和燒杯。(5)“碳化”時生成沉淀的化學式為 。7(12分)以煉鉛廠
7、鉛鋅煙灰(主要成分為ZnO,還含有少量Fe2+、Mn2+及微量其他重金屬離子)為原料生產氯化鋅的工藝流程如下:(1)“酸浸”時一般控制溫度為30 ,溫度不宜過高的原因是 。(2)“氧化”時需控制溶液的pH為5。寫出KMnO4氧化Fe2+為Fe3+的離子方程式 。實際生產中高錳酸鉀用量遠多于理論用量的原因是 。(3)物質A的化學式是 。(4)寫出流程中省略的操作步驟: ,若操作不當則會產生雜質Zn(OH)Cl,欲降低產品中該雜質的含量,可以采取的方法是 。8(12分)氫氧化鎂廣泛用作阻燃劑和填充劑。以白云石(化學式:MgCO3·CaCO3)為原料制備氫氧化鎂的工藝流程如下:(1)根據流
8、程圖,白云石“輕燒”分解的化學反應式是 。(2)“研磨”的目的是 。(3)加入氨水時反應的化學方程式為 ;檢驗Mg(OH)2沉淀是否洗滌干凈的方法是 。(4)本流程中可以循環利用的物質是 。(5)傳統工藝是將白云石高溫分解為氧化鎂和氧化鈣后提取,而該工藝采用輕燒白云石的方法,其優點是 。9(15分)含苯酚的工業廢水的方案如下圖所示:回答下列問題:(1)設備進行的是 操作(填寫操作名稱),實驗室這一步操作所用的儀器是 。(2)由設備進入設備的物質A是 。(3)在設備中發生反應的化學方程式為 。(4)在設備中,物質B的水溶液和CaO反應,產物是CaCO3、 和水,再通過過濾得產物。(5)上圖中,能
9、循環使用的物質是C6H6、CaO、NaOH水溶液、 。(6)寫出同時滿足下列條件的苯酚的一種同分異構體的結構簡式是 。核磁共振氫譜只有一個峰 分子中無碳碳雙鍵10(12分)工業上用碘酸鹽(碘酸為強酸)制備高碘酸(H5IO6,屬于弱酸),并用高碘酸在酸性介質中氧化Mn2生成MnO4,其流程如下圖所示:(1)反應是將碘酸鈉氧化為不溶于水的Na2H3IO6,該反應的化學方程式為_。反應得到的是不溶于水的黑色Ag5IO6,過濾的濾液呈_(填“酸”、“堿”或“中”)性。(2)無色氣體的名稱為_。白色濾渣的化學式為_。(3)工業上為降低成本,減少對環境的污染,整個流程需要控制加入氯氣和硝酸銀的物質的量之比
10、為n(Cl2)n(AgNO3)_。(4)氧化Mn2過程中,消耗1 mol H5IO6時,轉移2 mol電子,則該反應的離子方程式為_。11(12分)利用硫酸渣(主要含Fe2O3、FeO,雜質為Al2O3和SiO2等)生產鐵基顏料鐵黃(FeOOH)的制備流程如下:(1)“酸溶”時,Fe2O3與硫酸反應的化學方程式為 。(2)濾渣的主要成分是FeS2、S和 (填化學式);Fe3+被FeS2還原的離子方程式為 。(3)“氧化”中,生成FeOOH的離子方程式為 。(4)濾液中溶質是Al2(SO4)3和 (填化學式);“洗滌”時,檢驗鐵黃表面已洗滌干凈的操作是 。12(14分)用工業FeCl3粗品(含C
11、a、Mn、Cu等雜質離子)制取高純鐵紅,實驗室常用萃取劑X(甲基異丁基甲酮)萃取法制取高純鐵紅的主要實驗步驟如下:已知:HCl(濃)+FeCl3 HFeCl4試回答下列問題:(1)用萃取劑X萃取,該步驟中:Ca、Mn、Cu等雜質離子幾乎都在 (填“水”或“有機”)相。若實驗時共用萃取劑X 120 mL,萃取率最高的方法是 (填字母)。a一次性萃取,120 mL b分2次萃取,每次60 mL c分3次萃取,每次40 mL(2)用高純水反萃取,萃取后水相中鐵的存在形式是 (寫化學式);反萃取能發生的原因是 。(3)所得草酸鐵沉淀需用冰水洗滌,其目的是 。(4)測定產品中鐵的含量需經酸溶、還原為Fe
12、2+,然后在酸性條件下用標準K2Cr2O7溶液滴定,已知鉻的還原產物為Cr3+,寫出該滴定反應的離子方程式,并用單線橋標出電子轉移的方向和數目 。13四氯化鈦(TiCl4)是制取航天航空工業材料鈦合金的重要原料。由鈦鐵礦(主要成分是FeTiO3)制備TiCl4等產品的一種工藝流程示意圖如下:回答下列問題:(1)往中加入鐵屑至浸出液顯紫色,此時溶液仍呈強酸性。該過程中有如下反應發生:2Fe3+ + Fe = 3Fe2+2 TiO2+(無色)+ Fe + 4H+= 2Ti3+(紫色)+ Fe2+2 H2OTi3+(紫色)+ Fe3+ H2O = TiO2+(無色)+ Fe2+2H+加入鐵屑的作用是
13、 。(2)在工藝過程中需要控制條件以形成TiO2·nH2O溶膠,該溶膠的分散質顆粒直徑大小在范圍。(3)若把中制得的固體TiO2·nH2O用酸清洗除去其中的Fe(OH)3雜質,還可制得鈦白粉。已知25°C時,KspFe(OH)3 =2.79×10-39,該溫度下反應Fe(OH)3+3H+ Fe3+3H2O的平衡常數K= 。(4)已知:TiO2(s)+2Cl2(g)=TiCl 4(l)+O2(g) H+140kJ·mol12C(s)+O2(g) 2CO(g) H221kJ·mol1寫出中TiO2和焦炭、氯氣反應生成液態TiCl 4和CO
14、氣體的熱化學方程式: 。(5)上述工藝具有成本低、可用低品位礦物為原料等優點。依據綠色化學理念,該工藝流程中存在的不足之處是 (只要求寫出一項 )。(6)依據表格信息,要精制含少量SiCl 4雜質的TiCl 4,可采用 方法。TiCl4SiCl4熔點/-25.0-68.8沸點/136.457.614鈦被稱為“二十一世紀金屬”,工業上用鈦鐵礦制備金屬鈦的工藝流程如下:請回答下列問題:(1)鐵在元素周期表中的位置為 。(2)寫出TiO2+水解的離子方程式: 。加入過量鐵粉的作用是: ; 。(3)操作 的實驗步驟為:_,過濾。(4)副產品主要成分的化學式為 。(5)寫出TiO2轉化成TiCl4的化學
15、方程式: 。15(14分)硼及其化合物在工業上有許多用途。以鐵硼礦(主要成分為Mg2B2O5·H2O和Fe3O4,還有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)為原料制備硼酸(H3BO3)的工藝流程如圖所示:回答下列問題:(1)寫出Mg2B2O5·H2O與硫酸反應的化學方程式_。為提高浸出速率,除適當增加硫酸濃度濃度外,還可采取的措施有_(寫出兩條)。(2)利用 的磁性,可將其從“浸渣”中分離。“浸渣”中還剩余的物質是_(寫化學式)。(3)“凈化除雜”需先加H2O2溶液,作用是_。然后再調節溶液的pH約為5,目的是_。(4)“粗硼酸”中的主要雜質是 (填名稱)
16、。(5)以硼酸為原料可制得硼氫化鈉(NaBH4),它是有機合成中的重要還原劑,其電子式為_。(6)單質硼可用于生成具有優良抗沖擊性能硼鋼。以硼酸和金屬鎂為原料可制備單質硼,用化學方程式表示制備過程_。16(19分)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等雜質),實驗室利用毒重石制備BaCl2·2H2O的流程如下:(1)毒重石用鹽酸浸取前需充分研磨,目的是 。實驗室用37%的鹽酸配置15%的鹽酸,除量筒外還需使用下列儀器中的 。a燒杯 b容量瓶 c玻璃棒 d滴定管(2)Ca2+Mg2+Fe3+開始沉淀時的pH11.99.11.9完全沉淀時的pH13.911.13.2
17、加入NH3·H2O調節pH=8可除去 (填離子符號),濾渣中含 (填化學式)。加入H2C2O4時應避免過量,原因是 。已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9(3)利用簡潔酸堿滴定法可測定Ba2+的含量,實驗分兩步進行。已知:2CrO42+2H+=Cr2O72+H20 Ba2+CrO42=BaCrO4步驟I:移取xml一定濃度的Na2CrO4溶液與錐形瓶中,加入酸堿指示劑,用b mol·L1鹽酸標準液滴定至終點,測得滴加鹽酸體積為V0mL。步驟II:移取y mLBaCl2溶液于錐形瓶中,加入x mL與步驟相
18、同濃度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸堿指示劑,用b mol·L1鹽酸標準液滴定至終點,測得滴加鹽酸的體積為V1mL。滴加鹽酸標準液時應用酸式滴定管,“0”刻度位于滴定管的 (填“上方”或“下方”)。BaCl2溶液的濃度為 mol·L1,若步驟中滴加鹽酸時有少量待測液濺出,Ba2+濃度測量值將 (填“偏大”或“偏小”)。17(14分)從鋁土礦(主要成分是Al2O3,含SiO2、Fe2O3、MgO等雜質)中提取兩種工藝的流程如下:請回答下列問題:(1)流程甲加入鹽酸后生成Al3+的方程式為_(2)流程乙加入燒堿后生成SiO32的離子方程式為_(3)驗證濾液
19、B含Fe3+,可取少量濾液并加入_(填試劑名稱)。(4)濾液E、K中溶質的主要成份是_(填化學式),寫出該溶液的一種用途_(5)已知298K時,Mg(OH)2的溶度積常數KSP=56×1012,取適量的濾液B,加入一定量的燒堿達到沉淀溶液平衡,測得PH=1300,則此溫度下殘留在溶液中的c(Mg2+)=_18鋰被譽為 “金屬味精”, 以LiCoO2為正極材料的鋰離子電池已被廣泛用作便攜式電源。工業上常以-鋰輝礦 (主要成分為LiAlSi2O6, 還含有FeO、 MgO、 CaO等雜質) 為原料來制取金屬鋰。其中一種工藝流程如下:已知: 部分金屬氫氧化物開始沉淀和完全沉淀時的pH:Li
20、2CO3在不同溫度下的溶解度如下表:請回答下列問題:(1)用氧化物形式表示LiAlSi2O6的組成: _。(2)反應加入碳酸鈣的作用是_。(3)寫出反應中生成沉淀A的離子方程式: _。(4)洗滌所得Li2CO3沉淀要使用_ (選填 “熱水” 或 “冷水”), 你選擇的理由是_。(5)電解熔融氯化鋰生產鋰時, 陽極產生的氯氣中會混有少量氧氣, 原因是_。19(12分) ZrO2常用作陶瓷材料,可由鋯英砂(主要成分為ZrSiO4,也可表示為ZrO2·SiO2,還含少量Fe2O3、Al2O3、SiO2等雜質)通過如下方法制取。已知:ZrO2能與燒堿反應生成可溶于水的Na2ZrO3,Na2Z
21、rO3與酸反應生成ZrO2+。部分金屬離子在實驗條件下開始沉淀和完全沉淀的pH如下表。金屬離子Fe3+Al3+ZrO2+開始沉淀時pH1.93.36.2沉淀完全時pH3.25.28.0(1)熔融時ZrSiO4發生反應的化學方程式為 ,濾渣I的化學式為 。(2)為使濾液I的雜質離子沉淀完全,需用氨水調pH=a,則a的范圍是 ;繼續加氨水至pH=b時,所發生反應的離子方程式為 。(3)向過濾III所得濾液中加入CaCO3粉末并加熱,得到兩種氣體。該反應的離子方程式為 。(4)為得到純凈的ZrO2,Zr(OH)4需要洗滌,檢驗Zr(OH)4是否洗滌干凈的方法是 。20(16分)硅孔雀石是一種含銅礦石
22、,含銅形態為CuCO3·Cu(OH)2和CuSiO3·2H2O,同時含有SiO2、FeCO3、Fe2O3、Al2O3等雜質。以其為原料制取硫酸銅的工藝流程如圖:(1)完成步驟中稀硫酸與CuSiO3·2H2O反應的化學方程式:CuSiO3·2H2O+H2SO4CuSO4 +_+H2O;雙氧水的作用是_ 。(2)步驟調節溶液pH,可以選用的試劑是_。ACuO BFe2O3 CAl2O3 DCu(OH)2(3)有關氫氧化物開始沉淀和完全沉淀的pH如下表:氫氧化物Al(OH)3Fe(OH)3來Fe(OH)2Cu(OH)2開始沉淀的pH3.31.56.54.2沉淀
23、完全的pH5.23.79.76.7步驟中,調節pH=4時,所得濾渣B的成分的化學式為 ,濾液B中除Cu2+外, 還含有的金屬陽離子是 。(4)將濾液B通過 、 ,過濾等操作可得到硫酸銅晶體。測定硫酸銅晶體結晶水的含量時,應將其放入_中灼燒。加熱失水后,若在空氣中冷卻稱量,測定結果_ _(填“偏高”、“偏低”或“不變”)。21(14分)堿式硫酸鐵Fe(OH)SO4可用作凈水劑、媒染劑、顏料和藥物。工業上利用廢鐵屑(含少量氧化鋁、氧化鐵等),生產堿式硫酸鐵的部分工藝如下:已知:部分陽離子以氫氧化物形式沉淀時溶液的pH見下表:(1)反應I中發生的氧化還原反應的離子方程式是_。(2)反應II中加入Na
24、HCO3調節體系的pH在_范圍內。(3)反應III中生成的氣體遇空氣變紅棕色,則III中發生反應的離子方程式是_ 。(4)反應III中通入氧氣可減少NaNO2的用量,若消耗1mol氧氣可節約n(NaNO2)=_mol。(5)用硫酸可知體系的pH。若硫酸加入量過小,溶液生成沉淀;若硫酸加入量過大,不利于產品形成,用化學平衡移動原理分析其原因是_。(6)堿式硫酸鐵溶于水后生成的Fe(OH)2+離子可發生水解生成Fe2(OH)42+聚合離子,該水解反應的離子方程式是_。22(14分)聚合氯化鋁(化學式為Al2(OH)nCl6-nxH2Om)晶體是一種高效無機水處理劑,下圖是實驗室模擬工業制備聚合氯化
25、鋁晶體的工藝流程,制備原料主要是鋁加工行業的廢渣鋁灰,主要含Al2O3、Al,含有SiO2等雜質(1)試劑X(寫名稱)是_,操作2包含過濾、_和干燥。(2)生產過程中操作1的操作步驟_。(3)當m=1時,制備Al2(OH)nCl6-nxH2Om的離子方程式:_生產中要嚴格控制溶液中pH,過小,則氯化鋁水解不完全,且m值偏小,產品產量質量會降低而pH過大,產量也會降低,其原因是_(4)工業上采用電解裝置制取活潑金屬鋁,若陽極產生的氧氣全部與石墨電極反應生成CO和CO2氣體,若生產中每生成81 gAl,陽極損失石墨30g,則理論上產生CO的物質的量是_。23(14分)硅及其化合物在工業上有廣泛用途
26、,以硅粉、鎂粉等原料制備硅烷的工業流程如下:反應釜中發生反應:4NH4Cl+Mg2 Si 4NH3+SiH4+2MgCl2 H<0(1)工業上可用硅烷和氨氣生產一種能耐高溫的材料Si3 N4,Si3 N4應屬于 晶體;NH3、Si3 N4和SiH4三種物質的熔沸點由高到低的順序是 。(2)上述生產硅烷的過程中反應釜抽真空的原因是 。(3)液氨參與循環的作用是 。(4)氨氣也是重要的工業原料,1mol氨氣在一定溫度下(T>150)發生催化氧化反應能釋放出2265kJ的熱量,該反應的熱化學方程式是 。(5)三硅酸鎂(Mg2Si3O8·nH2O)難溶于水,在醫藥上可做抗酸劑。它
27、可以中和多余胃酸(主要成分鹽酸),生成的難溶物還可覆蓋在有潰瘍的胃表面,保護其不再受刺激。三硅酸鎂與胃酸反應的化學方程式是 。若將184g三硅酸鎂加到50mL 10mol/L鹽酸中,充分反應后,濾去沉淀,以甲基橙為指示劑,用l0mol/L NaOH溶液滴定剩余的鹽酸,消耗NaOH溶液30mL,則Mg2Si3O8·nH2O中n的值是 。24(18分)以鋁灰(主要成分為Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3雜質)為原料,可制得液體聚合氯化鋁 Alm(OH)nCl3mn,生產的部分過程如下圖所示(部分產物和操作已略去)。(1)Al2O3與鹽酸反應的離子方程式是_。(
28、2)濾渣I是_。濾渣2為黑色,該黑色物質的化學式是_。(3)向濾液2中加入NaClO溶液至不再產生紅褐色沉淀,此時溶液的pH約為3.7。其中NaClO的作用是_。該過程發生反應的離子方程式為_。(4)將濾液3的pH調至4.24.5,利用水解反應得到液體聚合氯化鋁。該反應的化學方程式為_。(5)Na2S溶液呈堿性的原因是_(用離子方程式表示)。該溶液中c(Na)_。25(13分)氯化鐵是一種重要的化學試劑和化工原料,工業上以黃鐵礦(主要成分為FeS2)為原料在制備硫酸的同時,利用其煅燒后爐渣的主要成分Fe2O3可制備氯化鐵晶體(FeCl3·6H2O),其工藝流程如下(雜質不參與反應):回答下列問題:(1)高溫煅燒時,黃鐵礦要粉碎成細小的顆粒,其目的是 。(2)黃鐵礦高溫煅燒時發生反應的化學方程式 。(3)酸溶及后續過程中均需保持鹽酸過量,其目的是 、 。(4)系列操作包括:蒸發濃縮、 、 、洗滌等。蒸發與過濾時玻璃棒的作用分別是: 、 。(5)取a g黃鐵礦,按上述流程制得FeCl3·6H2O晶體,將該晶體溶于水,再將所得溶液蒸干、灼燒,得到b g固體產物(整個過程中的損耗忽略不計),黃鐵礦的純度為 (用含a、b的表達式表示)。26(16分)利用明礬石(主要成分:K2SO4·Al2(SO4)3·2Al2O3·6H2O
溫馨提示
- 1. 本站所有資源如無特殊說明,都需要本地電腦安裝OFFICE2007和PDF閱讀器。圖紙軟件為CAD,CAXA,PROE,UG,SolidWorks等.壓縮文件請下載最新的WinRAR軟件解壓。
- 2. 本站的文檔不包含任何第三方提供的附件圖紙等,如果需要附件,請聯系上傳者。文件的所有權益歸上傳用戶所有。
- 3. 本站RAR壓縮包中若帶圖紙,網頁內容里面會有圖紙預覽,若沒有圖紙預覽就沒有圖紙。
- 4. 未經權益所有人同意不得將文件中的內容挪作商業或盈利用途。
- 5. 人人文庫網僅提供信息存儲空間,僅對用戶上傳內容的表現方式做保護處理,對用戶上傳分享的文檔內容本身不做任何修改或編輯,并不能對任何下載內容負責。
- 6. 下載文件中如有侵權或不適當內容,請與我們聯系,我們立即糾正。
- 7. 本站不保證下載資源的準確性、安全性和完整性, 同時也不承擔用戶因使用這些下載資源對自己和他人造成任何形式的傷害或損失。
最新文檔
- 運輸業務傭金合同協議
- 鄭州房車采購合同協議
- 買手房資金托管合同書
- 臨時用工勞動合同
- 安裝工程合作協議合同
- 車輛外包勞務合同協議
- 退貨折舊費合同協議
- 路燈維修協議合同協議
- 軟硬件采購合同協議
- 鄭州市裝飾裝修合同協議
- 醫學臨床三基訓練醫師分冊題庫及答案
- 2024年安徽安慶安桐城鄉發展集團有限公司招聘真題
- 上海市延安中學2024-2025學年高三下學期4月診斷考試數學試題含解析
- 退出股份合同協議
- 婚姻調查合同協議
- 10.1 美國課件2024-2025學年度七年級下學期人教版地理
- 受限空間作業施工方案
- 12.4 識讀墩臺結構圖
- 《細胞因子在炎癥反應中的作用》課件
- 2025屆上海市(春秋考)高考英語考綱詞匯對照表清單
- 醫院臨床輸血工作總結

評論
0/150
提交評論