



版權說明:本文檔由用戶提供并上傳,收益歸屬內容提供方,若內容存在侵權,請進行舉報或認領
文檔簡介
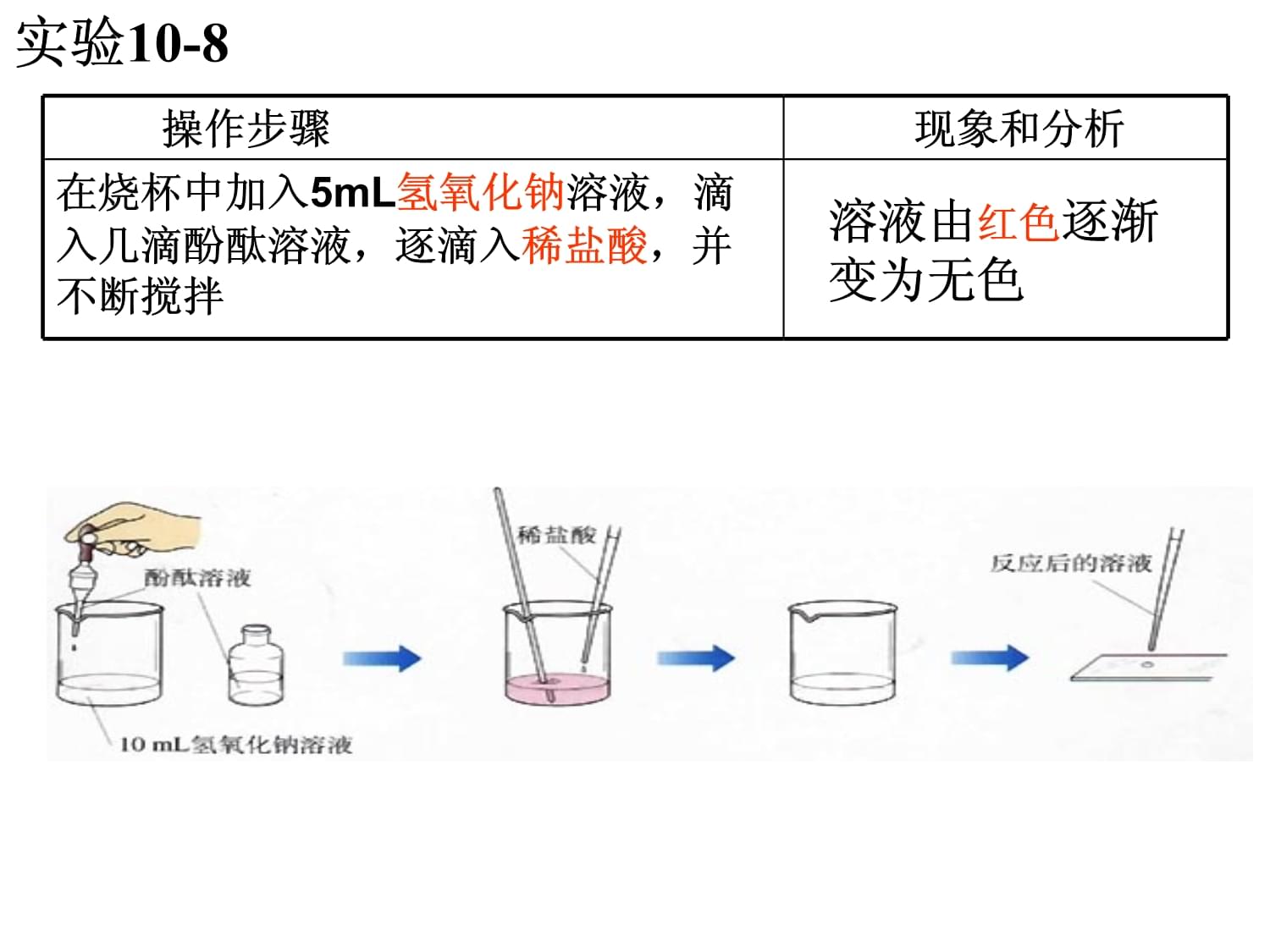
第十單元酸和堿課題2酸和堿的中和反應想一想酸和堿混合在一起,會發生化學反應嗎?實驗10-8
操作步驟
現象和分析在燒杯中加入5mL氫氧化鈉溶液,滴入幾滴酚酞溶液,逐滴入稀鹽酸,并不斷攪拌溶液由紅色逐漸變為無色討論1、氫氧化鈉與鹽酸反應了嗎?2、它們之間可能會生成什么物質?還會是氫氧化鈉嗎?你能寫出該反應的化學方程式嗎?氫氧化鈉(堿)和稀鹽酸(酸)發生的反應NaOH+HCl===NaCl+H2O堿酸金屬離子酸根離子鹽討論下列反應有何共同特點?NaOH+HCl==NaCl+H2OCa(OH)2+2HCl==CaCl2+2H2O2NaOH+H2SO4==Na2SO4+2H2O金屬離子酸根離子鹽鹽:由金屬離子和酸根離子組成的化合物中和反應:酸和堿作用生成鹽和水的反應酸+堿→鹽+水
“鹽”是指一類物質,和平時說的“食鹽”不同。常見的中和反應
酸+堿=鹽+水HCl+NaOH=NaCl+H2O2HCl+Ca(OH)2=CaCl2+2H2OH2SO4+2NaOH=Na2SO4+2H2OH2SO4+Ca(OH)2=CaSO4+2H2OHNO3+NaOH=NaNO3+H2O反應特征:H++OH-=H2O名稱氫氧化鈉硫酸氧化鐵化學式CuSO4類別1.下列物質屬于鹽的是()ACaOBCa(OH)2CCuSO4DHCl2.填寫下表(類別按酸、堿、鹽、氧化物填寫)CNaOH堿硫酸銅鹽H2SO4酸Fe2O3氧化物課堂練習一酸H++酸根離子堿金屬離子+OH-鹽金屬離子+酸根離子小結:化合物的分類名稱氫氧化鈉硫酸氧化鐵化學式CuSO4類別1.下列物質屬于鹽的是()A.CuOB.Cu(OH)2C.CuSO4D.HCl2.填寫下表(類別按酸、堿、鹽、氧化物填寫)CNaOH堿硫酸銅鹽H2SO4酸Fe2O3氧化物課堂練習一1.下列反應,屬于中和反應的是()A.Zn+2HCl==ZnCl2+H2B.CuO+2HCl==CuCl2+H2OC.Ca(OH)2+H2SO4==CaSO4+2H2OD.CaCO3+2HCl==CaCl2+H2O+CO2課堂練習二C二、中和反應在實際中的應用●改變土壤的酸堿性●處理工廠的廢水●用于醫藥◆中和胃酸◆制成含堿性物質的藥水,防蚊蟲叮咬想一想植物需要在一定酸堿性的土壤中生長,但近年來由于不合理使用化肥,或酸雨的形成,破壞土壤的酸堿性,不利于植物的生長。應怎樣去改變酸性土壤?用熟石灰中和。1、改變土壤的酸堿性根據土壤情況,可以利用中和反應,在土壤中加入酸性或堿性物質,以調節土壤的酸堿性,利用植物生長。
某硫酸廠排出的廢水中含有硫酸等雜質,嚴重危害當地的生態環境,你會怎樣處理這些廢水呢?你會處理廢水嗎?
應在排放前用堿性物質(例如熟石灰)進行中和處理。你能寫出化學方程式嗎?Ca(OH)2+H2SO4===CaSO4+2H2O2、處理工廠的廢水胃樂說明書[藥品名稱]
胃樂膠囊[性狀]本品為膠囊劑,內容物為灰黃棕色,氣味香,味微苦[主要成分]氫氧化鋁[Al(OH)3]、甘草提取物、白芨、木香等[藥理作用]中和胃酸過多、抗潰瘍、鎮痛、抗炎[功能與主治]用于慢性胃炎胃酸和多酸胃痛。行氣止痛,收斂生肌,促進潰瘍愈合。用于胃脹悶疼痛,噯氣泛酸,惡心嘔吐,氣滯引起的胃腕疼痛。[用法與用量]口服,一次2~3粒,一日3次,空腹服用[規格]0.4g/粒[貯藏]密封,置干燥陰涼處[包裝]20粒/盒[有效期]兩年胃樂好藥用心制造3、用于醫藥胃樂膠囊的主要成分胃酸的主要成分是鹽酸氫氧化鋁Al(OH)3+3HCl===AlCl3+3H2O氫氧化鋁能中和胃酸你能寫出化學方程式嗎?思考:為什么被蚊蟲叮咬過之后會覺得痛癢?有什么辦法會消除腫痛?
被蚊蟲叮咬后,叮咬處很快會腫成大包,這是因為蚊蟲能在人的皮膚內分泌出蟻酸,從而使皮膚腫痛。如果涂一些含有堿性物質(NH3·H2O)的藥水,就可減輕痛癢。吃堿面時,放點醋,味道會更美。吃堿面時,放點醋,味道會更美三、溶液酸堿度的表示法——pH溶液的酸堿性可用酸堿指示劑測定;溶液酸堿性的強弱程度(即溶液的酸堿度)常用pH來表示。pH的范圍:通常在0~14之間pH<7酸性溶液pH越小,溶液的酸性越強,堿性越弱。pH>7堿性溶液pH=7中性溶液測定pH的最簡便方法:pH試紙pH試紙(廣范pH試紙):測量值為整數標準比色卡測定方法:①在白瓷板或玻璃片上放一小片pH試紙②用玻璃棒或膠頭滴管取待測液于試紙上③把試紙顯示的顏色與標準比色卡對照問:pH試紙事先要潤濕嗎?不能,因為pH試紙是準確測試液的酸堿度的,用水濕潤后呈現出來的顏色會變淡,與比色卡對照易出現誤差。(1)測定幾種酸或堿的稀溶液的pH。①稀鹽酸②稀硫酸
③NaOH溶液④Ca(OH)2溶液結論:酸溶液的pH<7,堿溶液的pH>7。即:酸溶液顯酸性,堿溶液顯堿性。(2)測定幾種鹽溶液的pH。①NaCl溶液②Na2CO3溶液③CuSO4溶液結論:鹽溶液:pH<7或pH=7或pH>7。即:鹽溶液可能顯酸性、中性、堿性。思考:酸溶液一定是酸性溶液嗎?酸性溶液一定是酸溶液嗎?結論:酸溶液不等同于酸性溶液,堿溶液不等同于堿性溶液。酸性溶液酸溶液溶液酸堿度在實際生活中的重要意義把pH<5.6的降雨稱為酸雨人的胃液的正常pH在0.9~1.5之間,如不在此范圍內,則可能導致疾病。3.由金屬離子和酸根離子構成的化合物叫做鹽。學完本課題你應該知道:1.中和反應:中和反應在生活和生產中有廣泛的應用:⑴農業⑵工業⑶生活2.溶液的酸堿度可用pH表示,用pH試紙可以測定溶液的酸堿度。pH在0—14之間。⑵了解溶液酸堿度在實際中有重要的意義農業、工業、環境、生活酸+堿→鹽+水①pH
7,溶液呈中性,
②pH
7溶液呈酸性,PH越小,酸性越強,③pH
7溶液呈堿性,
PH越大,堿性越強。⑴溶液的酸堿性與pH的關系:﹥﹤=
1.某工廠排放的廢水的pH是4.5,取少量該廢水加入試管中,再滴酚酞溶液,溶液呈______色,如果要使試管里溶液的pH升高到=7,可以采用__________
的方法。無加堿性溶液練習:2、下列實
溫馨提示
- 1. 本站所有資源如無特殊說明,都需要本地電腦安裝OFFICE2007和PDF閱讀器。圖紙軟件為CAD,CAXA,PROE,UG,SolidWorks等.壓縮文件請下載最新的WinRAR軟件解壓。
- 2. 本站的文檔不包含任何第三方提供的附件圖紙等,如果需要附件,請聯系上傳者。文件的所有權益歸上傳用戶所有。
- 3. 本站RAR壓縮包中若帶圖紙,網頁內容里面會有圖紙預覽,若沒有圖紙預覽就沒有圖紙。
- 4. 未經權益所有人同意不得將文件中的內容挪作商業或盈利用途。
- 5. 人人文庫網僅提供信息存儲空間,僅對用戶上傳內容的表現方式做保護處理,對用戶上傳分享的文檔內容本身不做任何修改或編輯,并不能對任何下載內容負責。
- 6. 下載文件中如有侵權或不適當內容,請與我們聯系,我們立即糾正。
- 7. 本站不保證下載資源的準確性、安全性和完整性, 同時也不承擔用戶因使用這些下載資源對自己和他人造成任何形式的傷害或損失。
最新文檔
- T/CSWSL 038-2024飼料原料發酵谷物醋糟
- T/CAR 17-2024制冷智能零售柜
- 上海自愿離婚協議(協議文本)3篇
- 撤資協議書范本6篇
- 二手機動車買賣標準合同7篇
- 熬夜帶來的疾病
- 健康保養培訓課件
- 運動中急救知識
- 2025益陽職業技術學院輔導員考試試題及答案
- 2025贛南衛生健康職業學院輔導員考試試題及答案
- 批判教育學的流派和代表人物及其觀點
- 三年級下學期音樂復習題
- 農網配電營業工復習題
- 電氣畢業論文-基于-plc自動門控制設計
- 煉鋼廠風險分級管控清單連鑄區域
- 新時期農村初中語文教學中滲透心理健康教育的研究 論文
- 女性中醫保健智慧樹知到答案章節測試2023年暨南大學
- 餐飲員工入職登記表
- GA 1808-2022軍工單位反恐怖防范要求
- -衛生資格-副高-護理學-副高-章節練習-專科護理學-內科疾病患者護理(多選題)(共42題)
- 一帶一路 匠心織竹-計劃書

評論
0/150
提交評論